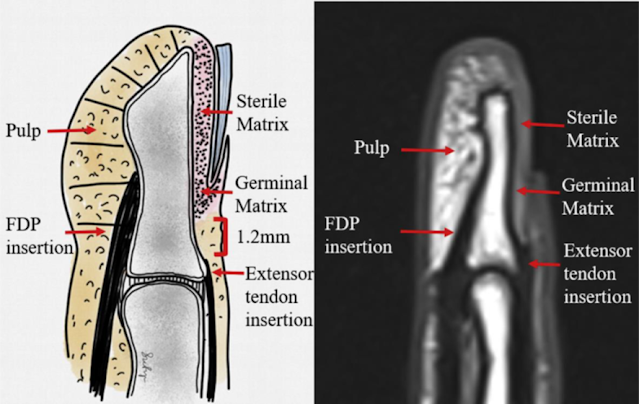
Las falanges de la mano son estructuras tubulares. Las
articulaciones interfalángicas proximales (IFP) y distales (IFD) permiten
movimientos de extensión y, sobre todo, de flexión. Los ligamentos colaterales estabilizan
las articulaciones y restringen el movimiento lateral de las mismas. La base de
la falange distal tiene unos tubérculos que son los puntos de inserción para
los ligamentos de la articulación interfalángica distal.
Las falanges distales están protegidas, en su zona dorsal, por la
placa de la uña, que actúa como una férula, previniendo la deformidad que
acompaña a la fractura [9].
Las falanges, posiblemente, son los huesos menos protegidos de
todo el esqueleto. Su exposición a los golpes, unida a las múltiples
tareas para las que se usan las manos diariamente, hacen que se pueda
formar un “tormenta perfecta” para las lesiones, por lo que las falanges
se encuentran entre los huesos más frecuentemente fracturados del cuerpo, y
entre las fracturas más comunes, en el conjunto de los huesos de la mano [3].
Causas
Las fracturas de la falange distal son el tipo más común de
fracturas de la mano, y el pulgar y el dedo corazón son los dedos
más afectados. En condiciones normales, la mayoría de las lesiones surgen de accidentes
laborales, lo que tiene sentido porque la punta del dedo es la parte más
expuesta de la mano, y el pulgar y el dedo corazón son los que presentan mayor
alcance longitudinal durante las tareas manuales. El mecanismo más frecuente de
lesión son los golpes con contundencia, aplastamiento (p. ej. de objetos
pesados en el trabajo), golpe con objetos pesados en distintas posturas de la
articulación interfalángica distal (p. ej. deportes con balón), y laceraciones
causadas por herramientas y/o maquinaria eléctrica. Las falanges distales
son el lugar más común de lesiones en la mano de un atleta [10].
Las fracturas de la base de la falange distal ocurren, por tanto,
debido a una fuerza axial que actúa sobre el dedo extendido, por regla general
durante la realización de deportes de pelota o por el choque directo del dedo
contra un obstáculo [1].
Diagnóstico
El examen físico, ante la sospecha de lesión en las falanges, debe
comenzar con un examen motor, seguido de un examen neurovascular detallado.
Las lesiones agudas, tendinosas y óseas, de la falange distal constituyen
actualmente un reto pues pueden dar lugar, independientemente del
tratamiento, a dolor crónico, hipersensibilidad, rigidez y deformidad del
dedo, que desemboca en un Síndrome de dolor regional complejo, de tipo
I, que son los que aparecen tras las lesiones óseas o de partes blandas, a
diferencia de los de tipo II, que se deben a lesiones nerviosas. La
fractura más importante en la falange distal es una fractura con avulsión de la
base de dicha falange, lo que suele dar lugar a una deformidad de dedo “en
martillo”.
La realización de radiografías, anteroposterior y lateral,
del dedo afectado, suele ser suficiente para alcanzar el diagnóstico.
Hay que tener en cuenta que las fracturas de la falange distal suelen
implicar también a los tejidos blandos del dedo, por lo que el tratamiento
de las fracturas óseas debe ir acompañado también del de las lesiones de dichos
tejidos. Estas heridas, en los tejidos, son causadas normalmente por una fuerza
de choque. Si, al mismo tiempo, la uña resulta dañada, entonces debe
extraerse, y la matriz ungueal debe ser reparada, y
posiblemente derivar a un especialista de la mano [4].
Tipos de tratamiento
Las fracturas estables, o mínimamente desplazadas, deben
ser tratadas de forma conservadora porque la envuelta del tejido blando
es lo suficientemente firme para permitir la soldadura de forma adecuada. Las fracturas
inestables, con un desplazamiento angular severo deben tratarse quirúrgicamente,
pues pueden producir alteraciones en la unión de los fragmentos y en el
crecimiento de la uña. Es preferible el uso de agujas de Kirschner ya
que es la técnica más directa, reproducible y con menor daño, tanto en la
articulación como en el complejo ungueal, cuando se realiza de manera correcta.
Una única aguja es suficiente en la mayoría de los casos, y se extrae, bajo
anestesia local, una vez la unión de los fragmentos está confirmada clínica
y radiológicamente, lo que suele ocurrir entre las 5 y las 6 semanas [8].
Los resultados clínicos del tratamiento, en la mayoría de estas fracturas,
están asociados a los daños de tejidos blandos más que a la lesión ósea.
La fijación interna se reserva para las fracturas inestables y/o
desplazadas donde una unión deficiente conllevaría consecuencias funcionales y
estéticas tales como la deformidad de la uña o de la punta del dedo, como puede
ser acabalgamiento de los fragmentos o falta de adherencia de la zona
fracturada. En las últimas revisiones, se indica que las fracturas de la
falange distal, sin incluir las fracturas en penacho, deben ser inmovilizadas
por debajo de la articulación IFD, en postura de extensión, durante 8 semanas
[13]. Por otro lado, parece que un periodo de inmovilización de 2 a 4 semanas
es el adecuado para las fracturas en penacho. En la mayoría de los casos,
cuando existe un desplazamiento, aunque éste sea mínimo, en las fracturas del
cuerpo de la falange, el tiempo mínimo de inmovilización es de 4 semanas.
El tratamiento no quirúrgico de las fracturas de falange se
realiza, a menudo, mediante la colocación de un yeso o una férula de
inmovilización durante más de 4 semanas. La intervención quirúrgica depende del
tamaño del fragmento, del grado de luxación del mismo y de la presencia de una
subluxación/luxación de la falange distal. Existe, además el peligro de
aparición de un síndrome de dolor regional complejo (SDRC tipo I) [2].
Las indicaciones para un tratamiento quirúrgico incluyen [5]:
• Incapacidad para obtener una reducción satisfactoria de la
fractura, con un acortamiento, rotación y/o angulación inaceptable.
• Fracturas abiertas con grave daño de tejidos blandos.
• Fracturas inestables.
En las fracturas diafisarias desplazadas, la lesión de la matriz
de la uña debe ser tenida en cuenta [12]. En el caso de afectación de dicha
matriz ungueal, es necesaria la extracción de la placa de la uña y la
reparación de la matriz, junto a la fijación con aguja de Kirschner de la
fractura diafisaria después de una reducción cerrada [11]. La aguja de
Kirschner se coloca en zona posterior a la mitad de la falange, con la
articulación interfalángica distal en extensión.
Cuando las fracturas se encuentran desplazadas e inestables, es
preferible una reducción cerrada con fijación percutánea con 2 agujas de
Kirschner cruzadas. La colocación cerrada de las agujas de Kirschner no provoca
el despegamiento del periostio y disminuye la frecuencia de adherencias
tendinosas y daños en la vascularización ósea. El punto de entrada de una aguja
de Kirschner debe ser justo debajo del lecho ungueal.
Las lesiones periarticulares de las articulaciones interfalángicas
distales pueden presentar diferente complejidad. Las lesiones de hueso en
martillo suelen deberse a hiperflexión forzada de la articulación
interfalángica distal, con rotura de la inserción del tendón extensor común de
los dedos, y afecta tanto al fragmento óseo como al articular. Estaslesiones
pueden ser tratadas de forma conservadora con un yeso extenso que incluya la
articulación interfalángica distal. Cuando más del tercio de la superficie de
la articulación está involucrada en la lesión, y existe una subluxación palmar
(es decir, en el lado de la palma de la mano) del resto de la falange, se lleva
a cabo un tratamiento quirúrgico. Alcanzar la congruencia de las superficies
articulares es obligatorio a la hora de evitar rigidez y artritis por una unión
alterada de la articulación interfalángica distal, ya sea con tratamiento
abierto o cerrado.
Las fracturas de falange desplazadas o inestables, o las fracturas
del extremo de la falange dolorosas suelen necesitar una reducción cerrada y
fijación con agujas de Kirschner, junto con la reparación de la matriz ungueal,
cuando esta última está afectada. Las agujas de Kirschner se dirigen, de forma
retrograda, desde la zona infraungueal distal (es decir, la zona de la punta de
la uña), justo por debajo del lecho ungueal, hasta la zona subcondral (por
debajo de la zona del cartílago de la articulación interfalángica) del
fragmento de la falange distal, sin cruzar la articulación interfalángica, sin
dañar, por tanto, dicha articulación.
La aguja se coloca para prevenir lesiones que se puedan producir
de forma inadvertida. Puede enterrarse dentro de la piel, o dejar un extremo
fuera de ella. Las ventajas de dejar la aguja dentro de la piel son la higiene,
la disminución de la tasa de infecciones, y la posibilidad de mojar el dedo.
Las desventajas es el esfuerzo a la hora de retirarla [6]. La retirada de la
aguja de Kirschner se realiza una vez existe la evidencia de que la curación
del hueso ha sido alcanzada, lo que usualmente ocurre alrededor de las 4
semanas.
El método de tratamiento ideal para este tipo de lesiones aún no
ha sido alcanzado. En un estudio, Hofmeister y su equipo [7] retiraron la aguja
a las 4 semanas. La sustituyeron por un yeso en la zona palmar de la falange
distal, durante otras 2 semanas, mientras permitían ejercicios de extensión en
estas últimas semanas. También reflejaron en el estudio que el uso de agujas de
Kirschner era la técnica menos cruenta de todas las que existen en la
actualidad.
Complicaciones
Las complicaciones que pueden aparecer, en el tratamiento de estas
lesiones, se deben a que las fracturas de cualquiera de las falanges tienen
potencial para desarrollar:
Falta de consolidación.
Deformidad del callo de fractura.
Infección de la zona.
Recuperación incompleta de la capacidad de movilidad de la
articulación IFD.
Las preocupaciones específicas, en el caso de la falange distal,
incluyen:
a)
Infección.
b)
Deformación de la matriz ungueal.
c)
Crecimiento deformado de la uña en los
pacientes pediátricos.
d)
Falta de consolidación ósea junto a dolor de
la zona de la lesión.
Con lesiones severas de los tejidos, la tasa de complicaciones
suele aumentar.
Todos los pacientes suelen presentar un periodo de, al menos, 6
meses, antes de verse libres de dolor, aunque en la mayoría de los casos,
vuelven a trabajar tras las primeras 6 semanas después de una fractura que no
afecte a la articulación.
BIBLIOGRAFÍA
[1] Schmidt B, Weinberg A, Friedrich H. “Der Mallet- Finger bei
Kindern und Jugendlichen”. Handchir Mikrochir Plast Chir 2008; 40:149–152.
[2] Szalay G., Schleicher I., Schlefer U.-R., Alt V., Schnettler
R. “El tratamiento de la fractura de la base de la falange distal del tercer
metacarpiano mediante placa gancho”. Orthop Traumatol 2011; 23:160–166.
[3] Day CS, Stern PJ. “Chapter 8. Fractures of the metacarpals and
phalanges”. Green’s Oper Hand Surg, 2015; 1:239–90.
[4] Carpenter S, Rohde RS. “Treatment of phalangeal fractures”.
Hand Clin 2013;29(4): 519–34.
[5] Bhatt R. A., Schmidt S., Stang F. “Methods and Pitfalls in
Treatment of Fractures in the Digits”. Clin Plastic Surg 41 (2014); 429–450.
[6] Ugurlar M, Saka G, Saglam N, et al. “Distal phalanx fracture
in adults: Seymour-type fracture”. J Hand Surg Eur 2014; 39:237–41.
[7] Hofmeister E, Mazurek M, Shin A, et al. “Extension block
pinning for large mallet fractures”. J Hand Surg Am 2003; 28:453–9.
[8] Liao J., Das De S. “Management of Tendon and Bony Injuries of
the Distal Phalanx”. Hand Clin 37 (2021); 27–42.
[9] Cotterell IH, Richard MJ. “Metacarpal and phalangeal fractures
in athletes”. Clin Sports Med 2015;34(1):69–98.
[10] Aitken S, Court-Brown CM. “The epidemiology of sports-related
fractures of the hand”. Injury 2008;39(12):1377–83.
[11] Chen F, Kalainov DM. “Phalanx fractures and dislocations in
athletes”. Curr Rev Musculoskelet Med 2017;10(1):10–6.
[12] Wahl E. P., Richard M. J. “Management of Metacarpal and
Phalangeal Fractures in the Athlete”. Clin Sports Med 39 (2020) 401–422.
[13] Sanderson M., Mohr B., Michael K. Abraham M. K. “The Emergent
Evaluation and Treatment of Hand and Wrist Injuries: An Update”. Emerg Med Clin
N Am 38 (2020) 61–79.